Quiz
Qual a célula mais intensamente parasitada pelo vírus HIV, que afeta o sistema imunitário dos infectados, tornando-os muito suscetíveis aos agentes infecciosos que usualmente não causam doenças?
Linfócito B.
Linfócito T citotóxico.
Linfócito T helper (auxiliar) (T4).
Linfócito Th17.
Natural Killer.
Quais as células que, quando ativadas por antígeno específico, proliferam e se diferenciam em plasmócitos que secretam grande quantidade de anticorpos?
Linfócito T citotóxico.
Linfócito T helper (auxiliar).
Linfócito T "virgens".
Linfócito B.
Macrófago.
Célula originada na medula óssea, desenvolvida no timo e que atua na resposta imune mediada por célula:
Neutrófilo.
Linfócito T.
Eosinófilo.
Basófilo
Linfócito B.
O Sistema Imune é composto por diversas células que, num primeiro momento, estão localizadas na corrente sanguínea. No momento de uma invasão por agente patogênico em um determinado tecido, essas células passam do vaso sanguíneo para o tecido conectivo em que irá exercer sua função de defesa. A célula e a passagem são, respectivamente, identificadas como:
Macrófagos e fagocitose.
Glóbulos brancos e endocitose.
Leucócitos e diapedese.
Leucócitos e endocitose.
Basófilos e pinocitose.
Na espécie humana, a defesa contra agentes patogênicos e substâncias estranhas que entram pelo tecido epitelial, que caracteriza a barreira de proteção primária do nosso corpo, é função do sistema imune. Com relação a esse sistema, é CORRETO afirmar que:
A imunidade humoral é mediada por uma célula efetora, o linfócito T citotóxico.
A resposta imunológica é desprovida de mecanismos de autorregulação e memória.
Todas as células do sistema imune são produzidas e diferenciadas na medula óssea, e saem maduras, prontas para sua atuação na defesa do nosso organismo.
A imunidade celular é mediada por uma molécula efetora chamada de anticorpo.
Os antígenos são as moléculas estranhas ao nosso organismo que provocam uma reação imune.
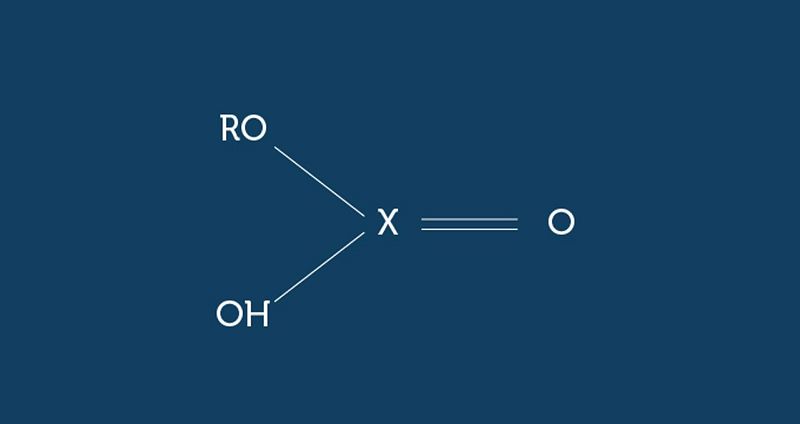
�De acordo com as ligações químicas indicadas na estrutura e para que o composto esteja corretamente representado, X deverá ser substituído pelo seguinte elemento:
Enxofre
Fósforo
Nitrogênio
Carbono
Cloro
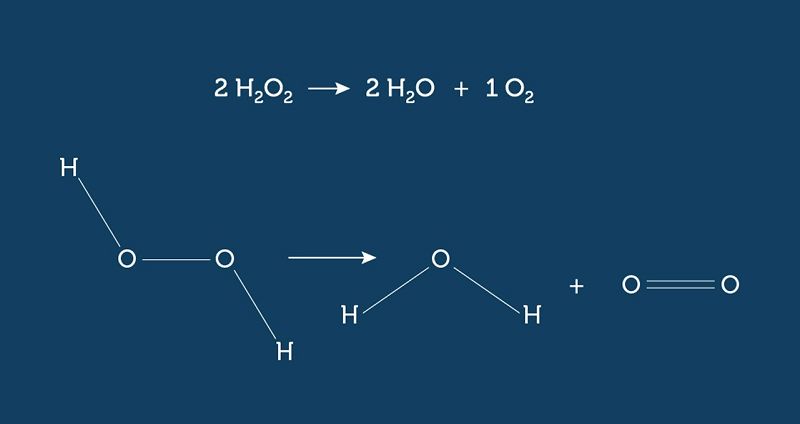
�A água oxigenada (H2O2), quando exposta à luz, decompõe-se e origina água e oxigênio. Essa reação pode ser representada pela equação:Com base na reação química descrita acima, o número de elétrons compartilhados para cada molécula de água oxigenada é igual a:
2
3
4
6
8
A combinação dos íons Ca2+, PO43– e OH– pode resultar no mineral presente em ossos e dentes, conhecido como hidroxiapatita. A fórmula química pode ser representada por Cax(PO4)3OH. Para determinar a quantidade necessária de cada íon para escrever a fórmula iônica, o valor de x nesta fórmula é:
1
2
3
4
5
Sabendo-se que, no composto ClOH, o cloro está ligado ao átomo de oxigênio e que o hidrogênio está ligado também ao átomo de oxigênio, pode-se afirmar que o cloro realizará:
Ligação covalente normal.
Ligação iônica.
Ligação metálica.
Ligação dativa.
Ligação covalente coordenada
O aumento na diferença de eletronegatividade entre os elementos ocasiona a seguinte ordem no caráter das ligações:
Iônica, covalente polar, covalente apolar.
Covalente polar, covalente apolar, iônica.
Iônica, covalente apolar, covalente polar.
Covalente apolar, iônica, covalente polar.
Covalente apolar, covalente polar, iônica.
Muitos materiais utilizados para confecção de objetos são encontrados na natureza. Por exemplo, as rochas do tipo metamórficas e ígneas são as matérias-primas para a confecção do mármore e do granito. O mármore é composto, principalmente, pelos minerais calcita e dolomita, enquanto o granito é formado por quartzo, feldspato, micas e anfíbolas. Ambos são utilizados na construção civil e passam pelo processo de polimento para apresentar a superfície lisa. A diferença entre mármore e granito é a densidade do material, devido à sua composição. Ainda, o mármore é menos denso do que o granito, pois o granito não apresenta tantos veios, sendo menos poroso. Nesse contexto, esses materiais formam uma mistura com sistema homogêneo ou heterogêneo? A transformação da pedra bruta metamórfica e ígnea em mármore e granito passa por um processo físico ou químico?
Mistura com sistema homogêneo. Transformação por processo químico.
Mistura com sistema homogêneo. Processo químico.
Mistura com sistema heterogêneo. Processo físico.
Mistura com sistema heterogêneo. Processo químico.
Não são consideradas misturas. Processo físico.
As soluções líquidas são as mais frequentes no estudo dos materiais pela Química. As bebidas gaseificadas, como refrigerantes e águas saborizadas, representam qual tipo de solução? Indique qual é o soluto e qual é o solvente nessas soluções. Considere água e dióxido de carbono como principais componentes.
Solução líquido-líquido. A água é o soluto e o dióxido de carbono é o solvente.
Solução líquido-líquido. A água é o solvente e o dióxido de carbono é o soluto.
Solução líquido-gás. A água é o soluto e o dióxido de carbono é o solvente.
Solução líquido-gás. A água é o solvente e o dióxido de carbono é o soluto.
Solução líquido-sólido. A água é o solvente e o dióxido de carbono é o soluto.
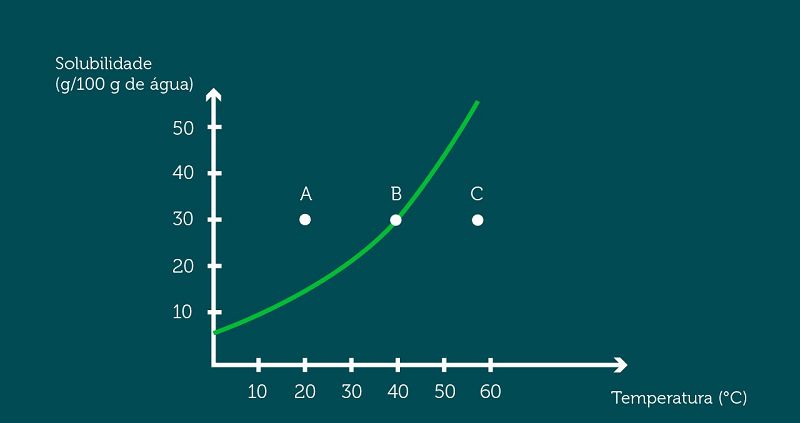
Insaturada, supersatura e insaturada.
Insaturada, saturada e insaturada.
Supersaturada, saturada e insaturada.
Supersaturada, insaturada e saturada.
Saturada, insaturada e supersaturada.
Considere os seguintes eventos de nosso cotidiano, expostos a seguir: I - Escrita com lápis sobre o papel. II - Fermentação de massa de pão. III - Precipitação de chuvas. IV - Redução de bolinhas de naftalina. V- Enferrujamento de porta de metal. Classifique os eventos listados em transformações químicas ou em transformações físicas da matéria.
I - Física. II - Química. III - Física. IV - Física. V - Química.
I - Química. II - Química. III - Física. IV - Química. V - Química.
I - Física. II - Química. III - Química. IV - Física. V - Química.
I - Química. II - Química. III - Física. IV - Química. V - Física.
I - Química. II - Física. III - Física. IV - Química. V - Física.
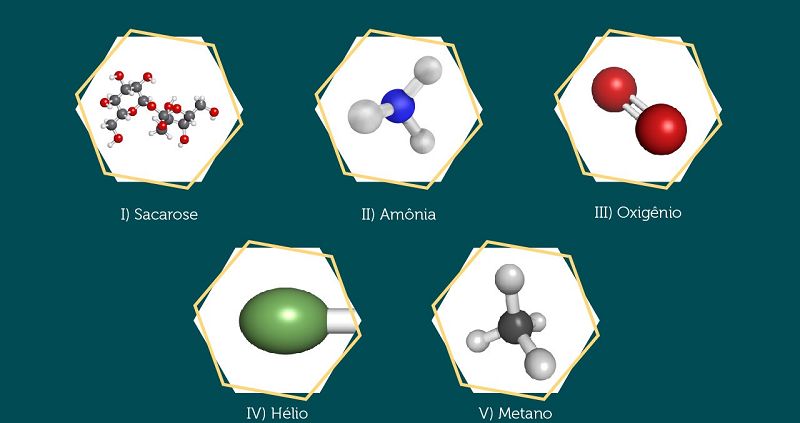
I - Substância composta. II - Substância simples. III - Substância composta. IV - Substância simples. V - Substância composta.
I - Substância simples. II - Substância composta. III - Substância composta. IV - Substância simples. V - Substância simples.
I - Substância composta. II - Substância composta. III - Substância composta. IV - Substância simples. V - Substância composta.
I - Substância simples. II - Substância simples. III - Substância simples. IV - Substância simples. V - Substância composta.
I - Substância composta. I - Substância composta. III - Substância simples. IV - Substância simples. V - Substância composta.
Sobre uma solução de glicose C6H12O6, 0,35 M, assinale a alternativa correta:
Haverá 63 g de glicose em 1 litro de solução.
Haverá 180 g de glicose em 1 litro de solução.
Haverá 5 g de glicose em 1 litro de solução.
Haverá 63 mols de glicose em 180g de solução.
Haverá 0,35g de glicose em 1 litro de solução.
Que quantidade em mols de permanganato de potássio KMnO4 está presente em 480 g desse sal? Dados (massa molar): K = 39, Mn = 55 e O =16.
1,52 mol.
6,08 mols.
3,04 mols.
2,50 mols.
0,0303 mols.
Sabendo que uma solução 1 molar de HCl tem 36,5 g.L-1 , qual a molaridade de uma solução composta de 125 g de HCl em 250 mL de solução? Sabendo que 1 mol HCl tem 36,5g)
0,29 Molar.
0,855 Molar.
13,7 Molar.
Não há dados suficientes para realizar esse cálculo.
6,8 Molar.
Você está preparando uma solução contendo 31,65 g de ácido sulfúrico (H2SO4) dissolvidos em 250 mL de solução? Sabendo que H = 1; S = 32; O = 16, assinale a alternativa correta:
A concentração dessa solução será de 2,6 Normal.
A concentração dessa solução será de 5,2 Normal.
A concentração dessa solução será de 1,3 Normal.
A concetração dessa solução não pode ser expressa em Normalidade (Normal), somente Molaridade (Molar).
0,64 Normal
No laboratório você se depara com um frasco contendo a seguinte informação no rótulo: Solução de 32,4578 g de NaOH em 800 mL de água. A concentração Molar (M) e a concentração Normal (N) dessa solução será, respectivamente:
A concentração será de 0,507 Molar e 1,014 Normal.
É impossível calcular a concentração Normal dessa solução.
A concentração será de 1,014 Molar e 0,507 Normal.
A concentração será de 0,507 Molar e 0,507 Normal.
A concentração será de 1,014 molar e 1,014 normal.
A análise de cátions é fundamental na determinação qualitativa de um determinado analito. Sobre os cátions, assinale a alternativa correta:
São elementos químicos que, após receberem elétrons, têm um número maior de prótons em relação aos elétrons.
São elementos químicos que, após doarem elétrons, têm um número maior de prótons em relação aos elétrons.
São elementos que têm tendência a receber elétrons, pois apresentam baixa eletronegatividade.
São elementos que têm tendência a receber elétrons, pois apresentam alta eletronegatividade.
São elementos que recebem um elétron e são representados com um sinal de +.
Sobre os cátions formados a partir dos elementos cálcio, estrôncio e ferro (forma férrica), assinale a alternativa que apresenta a forma corretade representá-los:
Ca+2, Sn+2, F+2.
Ca+,Sr+2, Fe+4.
Ca+2, Sn+2, Fe+2.
C+2, Sr+2, Fe+3.
Ca+2, Sr+2, Fe+3.
Sobre os compostos BaSO4, Al(OH)3, NH4Cl, K3PO4 e Zn(NO3)2, indique a alternativa que apresenta de forma correta o cátion, sua valência e sua atomicidade respectivamente:
Bário, monovalente, monoatômico.
Bario, trivalente, monoatômico.
Amônio, divalente, tetratômico.
Potássio, monovalente, triatômico.
Zinco, divalente, diatômico.
Durante a formação de cátions pelo teste de chama, formam-se cores características. Essas cores são o resultado de quê?
Da passagem de elétrons de camadas muito energéticas para camadas menos energéticas e absorvem a energia luminosa fornecida pela chama.
Da excitação de prótons que, ao saírem do núcleo, vão absorver energia térmica fornecida pela chama, cuja temperatura média é de 2000K.
Da reação química que existe entre o oxigênio do ar e do elemento químico, que em altas temperaturas formam óxidos de cor característica.
Da excitação de elétrons de camadas pouco energéticas para camadas mais energéticas e liberam a energia absorvida na forma de luz.
De um processo físico no qual o cátion passa do estado sólido ao gasoso e os elétrons passam de um átomo para outro presente na amostra.
O bário é um elemento muito utilizado em contrastes radiológicos por ser radiopaco. Identifique corretamente o cátion, sua cor na prova de chama e a reação de identificação:
Ba+2, verde, Ba+2(aq) + CrO4+2(aq) → BaCrO4(s).
Ba+1, azul, Ba+1(aq) + CrO4+2(aq) → Ba2CrO4(s).
Ba+2, amarelo, Ba+2(aq) + CrO4+2(aq) → BaCrO4(s).
Ba+3, verde, Ba+3(aq) + CrO4+2(aq) → Ba2(CrO4)3(s).
Ba+2, violeta, Ba+2(aq) + CrO4+(aq) → Ba(CrO4)2(s).
O fósforo é um elemento essencial na estrutura do ATP, uma molécula necessária para a produção de energia no organismo. Sobre o fósforo na forma de fosfato, o sal que apresenta a forma correta é:
Na3PO4.
Na2HPO3.
NaH2PO2.
PH3.
P2O5.
Os ânions têm diversas formas de identificação, entre as quais se incluem as reações formadoras de vapores gasosos. Entre os compostos abaixo, aquele que forma composto gasoso na presença de ácido é:
Ca2SO4.
Ca(C2O4)2.
H2CO3.
K3PO4.
KMnO4.
De forma geral, os ânions são íons que formam precipitados em meio aquoso. Você foi solicitado a preparar uma solução límpida, sem nenhum precipitado. Qual das alternativas abaixo formaria uma solução dessas?
H2SO4.
H3PO4.
HCl.
H2S.
HNO3.
Uma das formas de descobrir o ânion presente em uma solução é verificando o pH da solução contendo determinado sal. Das alternativas abaixo, aquele que formará uma solução alcalina após dissolução do sal é:
Na2SO4.
NaCH3CO2.
KCl.
K2SO4.
NaF.
O cálcio é um cátion que pode ser utilizado em diversas técnicas analíticas, incluindo a identificação de ânions. Isso ocorre pois, na presença dele, diversos ânions precipitam em meio aquoso. Dos ânions abaixo, qual deles precipita na presença de cálcio?
Acetato.
Clorato.
Sulfato
Perclorato.
Nitrato.
Qual das alternativas abaixo descreve o processo de dissolução de uma substância iônica?
Quando o soluto C12H22O11(s) é dissolvido em H2O(l), as moléculas de água rodeiam os íons formados em solução, com a extremidade positiva do dipolo da água orientado para os íons negativos e o dipolo negativo da água para os íons positivos.
Quando C2H5OH(l) é dissolvido em água, as interações dipolo-dipolo que se estabelecem entre as moléculas de água e as de etanol (ligações de hidrogênio) são da mesma ordem de grandeza das atrações do mesmo tipo existente entre as moléculas do etanol, bem como entre as moléculas de água.
A dissolução do CCl4(s) ocorre quando as moléculas do solvente H2O(l) envolvem as partículas de sólidos do soluto, dissolvendo-os.
Quando o soluto CaCl2(s) se dissolve no solvente C2H5OH(l), as partículas do soluto dispersam-se pelo solvente. As partículas do soluto vão se dissociar em íons e ocupar posições que são normalmente preenchidas por moléculas do solvente.
O processo de dissolução do soluto CO2(s) ocorre em H2O(l), pois as moléculas do solvente bombardeiam as partículas periféricas de CO2, fazendo com que as mesmas se desprendam e se dispersem no líquido, ficando rodeadas por moléculas de H2O.
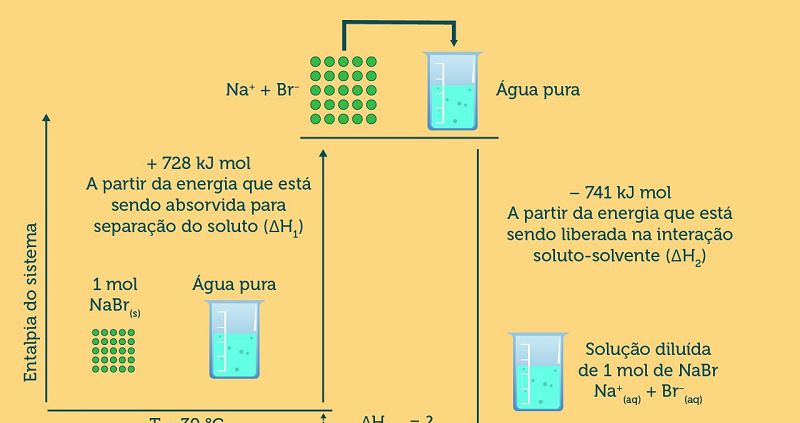
Avalie as trocas de entalpia entre o sistema e o meio, quando um 1 mol de NaBr(s) se dissolve em água, a uma pressão constante, para formar uma solução diluída. A energia total de formação de solução é um processo endotérmico ou exotérmico?
Endotérmico, pois a formação da solução libera 13 kJ/mol de energia.
Exotérmico, pois a formação da solução libera 13 kJ/mol de energia.
Endotérmico, pois a formação da solução absorve -13 kJ/mol de energia.
Exotérmico, pois a formação da solução absorve -13 kJ/mol de energia.
Esta reação é um processo neutro em que as energias envolvidas se compensam e não ocorre liberação e nem absorção de energia.
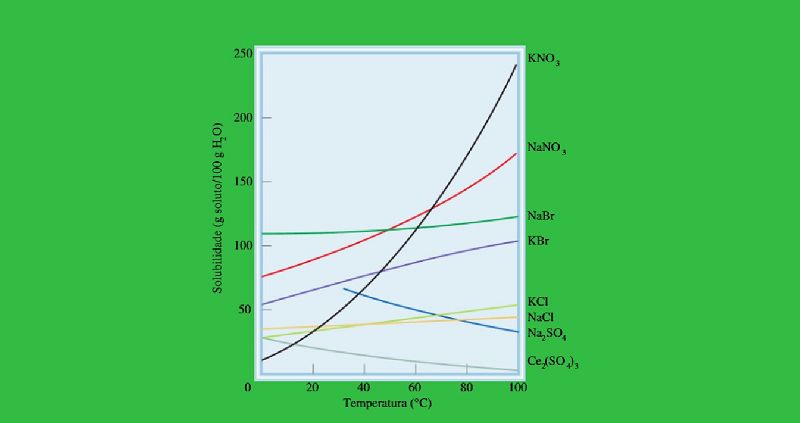
Suponha a preparação de uma solução saturada de KNO3 em 100 g de água, a 60 °C, e posteriormente resfriada até 20 °C. Após o resfriamento, quando a solução é agitada ela passa a ser classificada como?
Não–saturada, com possibilidade de dissolver mais soluto.
Saturada, com cristais de excesso depositados ao fundo da solução.
Supersaturada, com excesso de soluto dissolvido.
Supersaturada, com cristais de excesso depositados ao fundo da solução.
Saturada, sem alteração na solução.
A dissolução de 5g KOH(s) em 100 mL de H2O(l) forma uma solução homogênea e com caráter básico. Como essa solução pode ser classificada avaliando os estados físicos do soluto e do solvente e ainda a natureza do soluto (considerando a propriedade do soluto em conduzir ou não corrente elétrica em solução aquosa)?
Sólida e eletrolítica.
Líquida e eletrolítica.
Sólida e não-eletrolítica.
Líquida e não-eletrolítica.
Gasosa e não-eletrolítica.
Para formar uma solução contendo como soluto o iodo (I2), que é um composto com ligações covalentes, é mais aconselhável dissolver o mesmo utilizando como solvente água (H2O) ou álcool (CH3CH2OH)?
Utilizar CH3CH2OH(l), pois quando I2(s) é misturado com o mesmo formam ligações intermoleculares dipolo induzido-dipolo permanente, formando uma solução em que os componentes estão misturados uniformemente em nível molecular.
Utilizando CH3CH2OH(l), pois o solvente e o soluto neste caso possuem o momento dipolo diferente de zero e isso faz com que ambas as substâncias sejam moléculas polares, formando assim uma solução homogênea.
Utilizando H2O(l), pois o soluto I2, apesar de ser uma substância com ligações covalentes no seu estado puro, pode se dissociar em íons I- em água, formando uma solução eletrolítica.
Utilizando H2O(l), pois I2 possui momento dipolar zero, formando uma molécula apolar e para a água o momento é diferente de zero, formando uma molécula polar. Essa diferença de polaridade entre as substâncias faz com que a água solubilize o I2, formando uma solução.
Utilizando qualquer um dos dois solventes o soluto não será solúvel, pois o I2 é uma substância covalente insolúvel em líquidos indiferentemente de sua natureza.
Entre as afirmativas a seguir, qual delas representa a definição correta de um sistema em equilíbrio?
O sistema reacional pode estar aberto ou fechado, desde que o equilíbrio seja dinâmico.
Apresenta apenas produtos, pois uma reação em equilíbrio se processa por completo em alta velocidade, com deslocamento para a direita, no sentido dos produtos.
Apresenta propriedades microscópicas, isso é, aquelas que podem ser medidas, como temperatura, pressão e concentração constante.
O equilíbrio do sistema não se modifica quando for alterada a concentração de algum dos produtos ou reagentes, pois o sistema está em equilíbrio e isso nunca se altera.
Apresenta os processos microscópicos, isso é, as reações direta e inversa ocorrem simultaneamente e com a mesma velocidade. É por isso que o equilíbrio é chamado de dinâmico.
A reação de decomposição do cloreto de nitrilo, NO2Cl(g), está em equilíbrio com o NO2(g) e o Cl2(g). Monte a reação química e calcule a constante de equilíbrio, Kc. Para isso, considere que as concentrações no equilíbrio são [NO2Cl] = 0,00106 mol, [NO2] = 0,0108 mol e [Cl2] = 0,00538 mol e não se esqueça de realizar o balanceamento da equação química.
2NO2Cl(g) → 2NO2(g) + Cl2(g). Kc =4,080.
2NO2Cl(g) ↔ 2NO2(g) + Cl2(g). Kc = 4,080.
2NO2Cl(g) ↔ 2NO2(g) + Cl2(g). Kc = 0,558.
NO2Cl(g) ↔ NO2(g) + Cl2(g). Kc = 4,080.
2NO2Cl(g) → NO2(g) + Cl2(g). Kc = 0,558.
Em um recipiente de 1 litro são introduzidos 5,0 mol de N2O4 que se transformam em NO2, segundo a equação N2O4(g) ↔ 2NO2(g), em temperatura de 30 °C e pressão de 1 atm. Uma vez atingindo o equilíbrio, resta no sistema 1,3 mol de reagente. Calcule Kc na temperatura e pressão desse experimento, utilizando a tabela que faz a contabilidade das quantidades que participam do processo:
42,00.
3,846.
0,023.
5,562.
0,175.
Utilizando as mesmas condições da reação em equilíbrio do exercício anterior, calcule o grau de equilíbrio da reação: N2O4(g) ↔ 2NO2(g), conforme indica a tabela a seguir.
1,35.
0,17.
0,74.
0,47.
0,5.
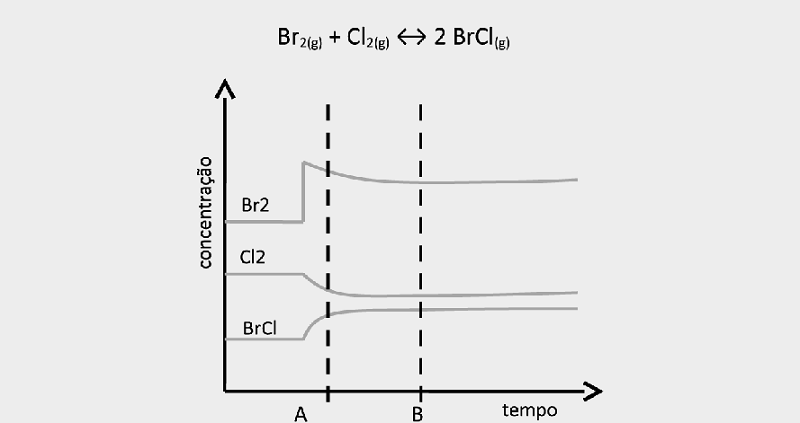
O gráfico a seguir se refere às concentrações de Br2(g), Cl2(g) e BrCl(g) dentro de um sistema com volume e temperatura constante. Inicialmente, dentro do sistema, existe o seguinte equilíbrio:Analise o gráfico e responda o que ocorre entre o tempo A e o tempo B?
O equilíbrio químico da reação se desloca para a direita, pois mais Cl2 foi adicionado ao sistema e, assim, ele busca um novo equilíbrio.
O equilíbrio químico se desloca para a esquerda, ou seja, para a formação dos reagentes, pois a concentração de BrCl foi elevada. Dessa forma, aumentam também as concentrações de Br2 e Cl2.
Alguma perturbação ocorreu no sistema, mas não é possível identificar para onde o equilíbrio químico se deslocará.
O equilíbrio químico se desloca para a direita, pois o equilíbrio foi deslocado pelo efeito do aumento da concentração de Br2.
O equilíbrio se desloca para a esquerda, a fim de consumir a quantidade de Cl2 adicionada ao sistema, restabelecendo o equilíbrio.
{"name":"Quiz", "url":"https://www.quiz-maker.com/QPREVIEW","txt":"Qual a célula mais intensamente parasitada pelo vírus HIV, que afeta o sistema imunitário dos infectados, tornando-os muito suscetíveis aos agentes infecciosos que usualmente não causam doenças?, Quais as células que, quando ativadas por antígeno específico, proliferam e se diferenciam em plasmócitos que secretam grande quantidade de anticorpos?, Célula originada na medula óssea, desenvolvida no timo e que atua na resposta imune mediada por célula:","img":"https://www.quiz-maker.com/3012/CDN/90-4378083/200a17f0-78ba-4a10-98de-b83b50ffa0b9.jpg?sz=1200-00000000001000005300"}